遺伝子療法の価格はどこまで下げられるのか?
遺伝子療法は難病を治療する革命的な方法だが、高額過ぎることがネックになって市場を得られずにいる。ただし、ターゲットとする患者数が増えると、価格が低下する傾向にあるため、今後、比較的低価格の遺伝子療法が登場するかもしれない。 by Emily Mullin2017.10.27
ヒトのDNAに新たな遺伝物質を取り入れる遺伝子療法は、極めて稀な疾病のいくつかを治療する革命的な方法として開発された。
製薬会社は適合する患者の数が少ない疾病の治療法に天文学的な価格を付けてきた。その結果、ある会社は欧州で市場から撤退してしまったし、また別の会社は患者を取り込もうと苦心惨憺している。
先週承認されたある遺伝子療法は、こうした状況を打破するかもしれない。製薬会社のカイト・ファーマ(Kite Pharm)が開発した「イエスカルタ(Yescarta)」は、がん細胞を攻撃するようにヒトの免疫細胞のDNAを改変する遺伝子療法としては2番目だ。イエスカルタがこれまで承認されてきた遺伝子療法と一線を画するのは、治療の対象となる患者の数がずっと多いことだ。
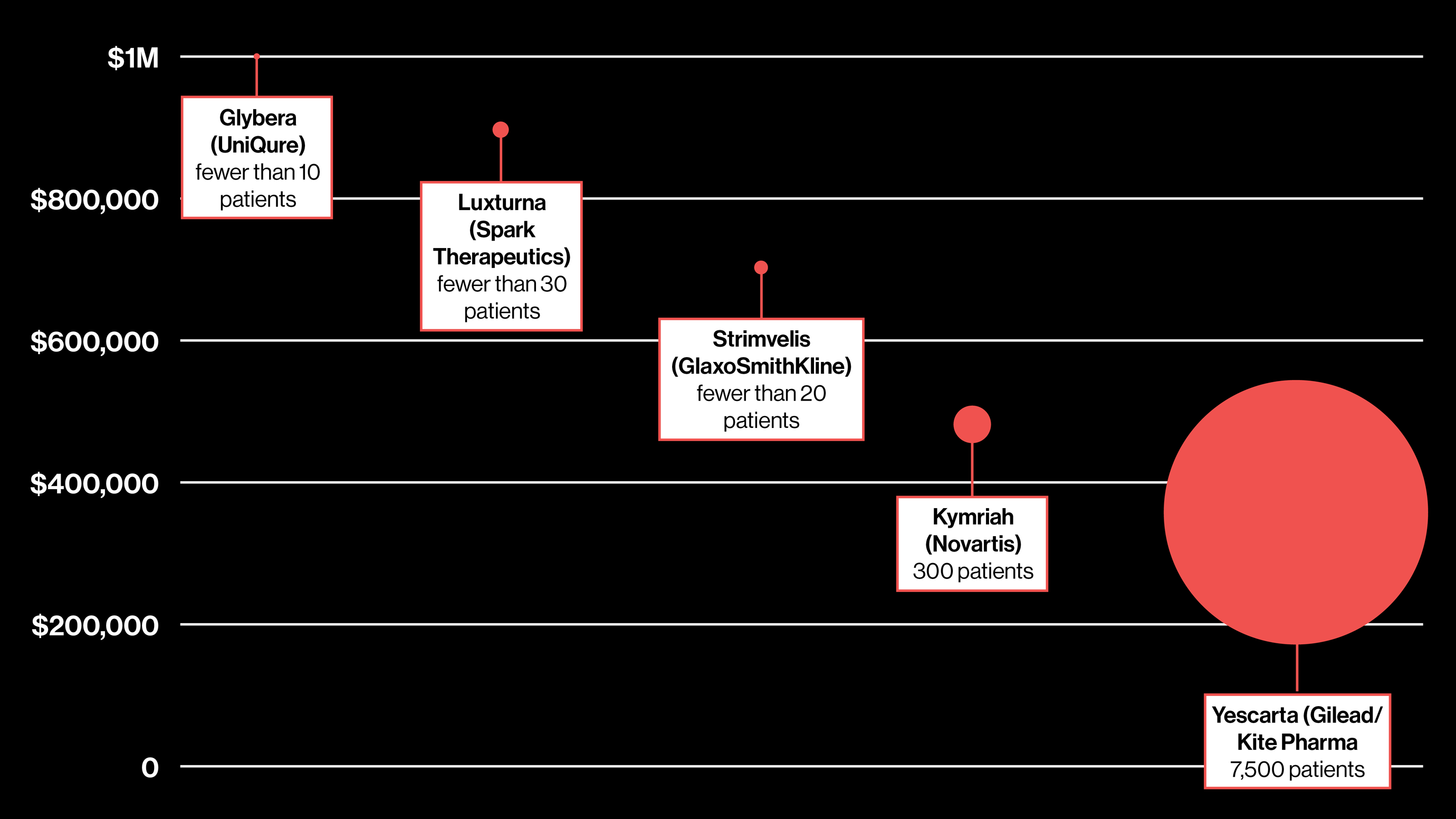
遺伝子療法の価格と年間の推定患者数につながりがあるかどうか知るために、米国と欧州で承認されているいくつかの遺伝子療法と、米国で未承認のひとつの遺伝子療法について、数値をプロットしてみた(記事冒頭のグラフ)。
生命科学コンサルティング会社のトリニティ・パートナーズ(Trinity Partners)のマネージング・パートナーであるハーマン・サンチェスは、患者数と療法の価格には相関があると話す。適合する患者が少ないほど、価格は高騰するのだ。見ての通り、年間の患者数はわずか数人から7500人ほどである一方で、価格は37万3000ドルから100万ドルの範囲に分布している。
サンチェスは「最も少ない疾病が市場でより強い価格決定力を持っています」という。「保険者(連邦政府、民間保険会社、個人など医療コストを支払う資金を供給する者)が多くの患者に対応する必要がないからです」。
これまでのところ、イエスカルタは他の値から大きく外れている。8月にカイトファーマを買収した生命科学の巨大企業ギリアド・サイエンシズによると、イエスカルタは年間7500人の患者を救う可能性がある。ヨーロッパで承認された2つの遺伝子療法「グリベラ(Glybera)」と「ストリムベリス(Strimvelis)」の適合患者数の少なさと比べてほしい。一方、米国においては、ノバルティスが、ある小児白血病に有効な遺伝子療法「キムリア(Kymriah)」に適合する患者は年間300人になるだろうとしている。より多くの患者がいれば、ギリアド・サイエンシスも価格をより低く設定できるので、最終的には、総売上高が増加するだろう。
イエスカルタの価格はそれでもまだ患者支援団体からの抗議を呼び起こした。しかし、米国だけでそれぞれ2万人の患者がいる血友病や、10万人の患者がいる鎌状赤血球症といった、より患者数の多い疾病の治療向けに開発中の遺伝子療法にはよい前兆となっている。
より発症数の多い疾病がターゲットであれば、「競合企業に勝つために価格を下げようとする傾向はより強くなるでしょう」とサンチェスはいう。
次に承認が待たれる遺伝子療法はスパーク・セラピューティクス(Spark Therapeutics)の「ラクスターナ(Luxturna)」で、ある種の遺伝性の失明患者の視力を回復するものだ。10月に入ってから第三者委員会が、米国食品医薬品局(FDA)にラクスターナを承認するよう全会一致のもとで勧告した。FDAは来年の1月12日までに決断しなければならない。
スパーク・セラピューティクスによると、この治療法は網膜細胞の変異遺伝子を取り替えることで視力を回復させるもので、米国内で1000人から2000人の患者が適合し得るという。治療し得る患者数の年間見込みの提供を同社が拒んだため、私たちはラクスターナの治療対象となる失明の推定発症率をもとに値を出した。アナリストは両眼を治療するのに80万ドルから100万ドルかかるだろうと試算している。
企業、保険会社、患者らにとって、このことすべてが何を意味するかは漠然としている。スパーク・セラピューティクスのような企業は、開発した治療法が当局の承認を勝ち得ると、今度は価格設定のジレンマに直面することになる。米国の保険会社はそれらの治療法を保険の適用範囲に含めるかどうかについて、今のところ沈黙を守っている。一方で、深刻な病状の患者たちは、高価すぎて治療を受けられないということがないように祈っている。
- 人気の記事ランキング
-
- China figured out how to sell EVs. Now it has to deal with their aging batteries. 中国でEV廃車ラッシュ、年間82万トンのバッテリー処理追いつかず
- Quantum navigation could solve the military’s GPS jamming problem ロシアGPS妨害で注目の「量子航法」技術、その実力と課題は?
- Text-to-image AI models can be tricked into generating disturbing images AIモデル、「脱獄プロンプト」で不適切な画像生成の新手法
- How social media encourages the worst of AI boosterism GPT-5が「未解決問題解いた」 恥ずかしい勘違い、なぜ?
- エミリー マリン [Emily Mullin]米国版
- ピッツバーグを拠点にバイオテクノロジー関連を取材するフリーランス・ジャーナリスト。2018年までMITテクノロジーレビューの医学生物学担当編集者を務めた。